添加日期:2017年8月29日 阅读:2183
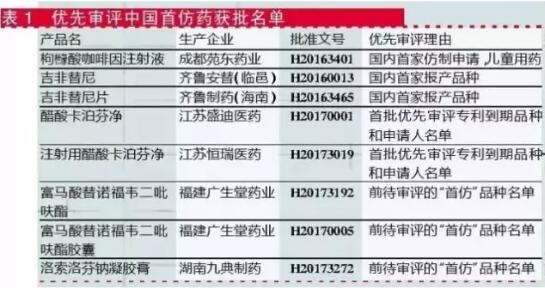
国产药:首仿药获批产品数*多
国产药纳入优先审评的10个批文中,有8个批文是首仿药(见表1)。例外的2个:一是同步递交美国ANDA申请,已通过FDA现场检查海南普利制药有限公司的注射用阿奇霉素;另一个则是以抗艾滋病药物为由获批的安徽贝克生物制药有限公司富马酸替诺福韦二吡呋酯片。
进口药:获批理由大多为“更具治疗优势”
进口药方面,获得优先审评的理由大多为“更具治疗优势”。如表2所示,笔者每次看到CDE给进口新药优先审评的理由是“与现有治疗手段相比具有明显治疗优势”之类的评语,总有一种创新性都被进口新药“承包”的感觉。
从治疗领域来看,进口新药优先审评获批的还是以抗肿瘤靶向药为主,如阿法替尼片、优先审评中上市获批时间*短的甲磺酸奥希替尼片、治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤的维莫非尼片、治疗原发性骨髓纤维化(PMF)的磷酸芦可替尼片、治疗晚期转移性结直肠癌(CRC)的瑞戈非尼片。
排名第二的治疗领域为治疗丙型肝炎病毒药,百时美施贵宝(中国)投资有限公司的阿舒瑞韦软胶囊和盐酸达拉他韦片在2017年获批,用于成人慢性丙型肝炎的联合治疗。CFDA还是对盐酸达卡他韦片和阿舒瑞韦软胶囊提出了上市后监测与评价的相关要求。由此可见,进口新药虽然上市审评获得批文速度加快,但后续还是要补做相关的临床试验。
儿童药:孤儿药上市免临床,上市后补试验
儿童药共3个产品获批,其中麦格司他胶囊和枸橼酸咖啡因注射液是孤儿药。

麦格司他胶囊是葡萄糖神经酰胺合成酶抑制剂。该产品于2006年被欧洲药品管理局认定为治疗C型尼曼匹克病的孤儿药,2009年获准用于治疗成年及青少年C型尼曼匹克病患者的进行性神经症状,随后该品相继在澳大利亚、加拿大、瑞士、日本等30多个国家获准用于治疗C型尼曼匹克病。目前,该产品为全球**批准治疗C型尼曼匹克病的药物。
在我国,2013年CDE的审评概述栏目中提到,“在安全有效性有依据,风险可以控制的情况下,同意本品在我国条件性批准上市”。其中批准条件为“上市后需在国内进行规范的临床试验,病例数15例,临床用药时间至少1年,以对本品用于中国患者的有效性、安全性、剂量等进行评估,了解症状改善情况和不良反应发生率、不良反应严重程度及处置办法等”。但直到2016年获批前,一直没有查到麦格司他胶囊获批的批文。
此外,曾经以儿童药进入拟纳入优先审评名单但*终没有进入优先审评名单的一品红盐酸克林霉素棕榈酸酯颗粒和盐酸克林霉素棕榈酸酯分散片,于2017年获得增补规格。
小结:
国产厂家获得优先审评并获批上市的以首仿药为主。进口厂家获得优先审评并获批上市的是“全球新”的新药,其批量上市后主要影响的领域是肿瘤药市场。
进口新药的优先审评平均获批速度较国产优先审评速度快。由表4可见,多中心临床减免了上市所需的临床数且加快了上市速度,个别新药申报案例数较少,获批后CDE会要求增加开展上市后临床监测。
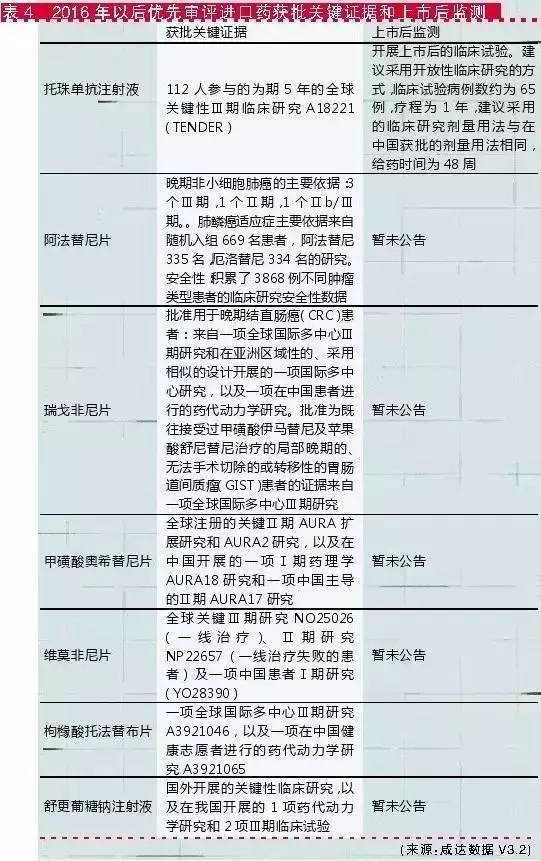
从临床数据核查到多中心证据认可的加快上市,都可以看出临床证据在药品研发注册过程中的地位越来越重要。临床数据作为药品研发企业核心竞争力,国内研发企业不要仅仅满足于对真实性的基本管理要求,还要从科学挖掘角度出发管理上市前后的临床数据。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号